UTILIZACION DE RANOLAZINA PARA LA PREPARACION DE UN MEDICAMENTO PARA EL TRATAMIENTO DE LAS POSDESPOLARIZACIONES PRECOCES (EAD).
Compuesto seleccionado de entre el grupo constituido por un compuesto de fórmula I:
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08004276.
Solicitante: CV THERAPEUTICS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3172 PORTER DRIVE,PALO ALTO, CA 94304.
Inventor/es: BELARDINELLI, LUIZ, ANTZELEVITCH,CHARLES, BLACKBURN,BRENT.
Fecha de Publicación: .
Fecha Solicitud PCT: 4 de Abril de 2003.
Fecha Concesión Europea: 9 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K31/495 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con seis eslabones con dos nitrógenos como únicos heteroátomos de un ciclo, p. ej. piperazina (A61K 31/48 tiene prioridad).
Clasificación PCT:
- A61K31/495 A61K 31/00 […] › que tienen ciclos con seis eslabones con dos nitrógenos como únicos heteroátomos de un ciclo, p. ej. piperazina (A61K 31/48 tiene prioridad).
- A61P9/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › Antiarrítmicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
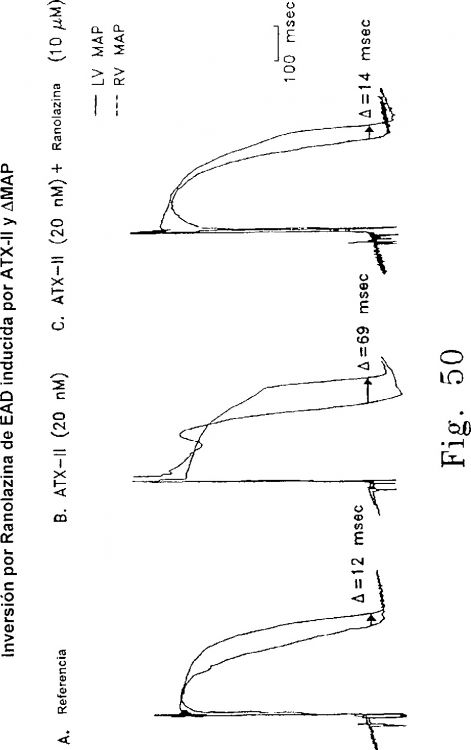
Fragmento de la descripción:
Utilización de ranolazina para la preparación de un medicamento para el tratamiento de las posdespolarizaciones precoces (EAD).
Campo de la invención
La presente invención se refiere al objeto de la reivindicación 1.
Antecedentes de la invención
El corazón es, en esencia, una bomba responsable de circular la sangre en todo el cuerpo. En un corazón que funciona normalmente dicha circulación es producida por la generación de impulsos eléctricos que, por ejemplo, aumentan o disminuyen la frecuencia cardíaca y/o la fuerza de contracción en respuesta a las demandas del sistema circulatorio.
Los impulsos eléctricos del corazón pueden detectarse y presentarse eléctricamente (electrocardiograma, EKG) y la forma de onda eléctrica del EKG se caracteriza por un acuerdo aceptado como complejo "PQRST". El complejo PQRST incluye la onda P, que corresponde a la onda de despolarización auricular; el complejo QRS, que corresponde a la onda de despolarización ventricular; y la onda T, que representa la repolarización de las células cardíacas. Por lo tanto, la onda P está asociada a la actividad en las cámaras cardíacas superiores y el complejo QRS y la onda T reflejan ambos la actividad en las cámaras inferiores.
Si la señal eléctrica llega a perturbarse de alguna manera, la acción de bombeo eficaz del corazón puede deteriorarse o incluso interrumpirse completamente. La perturbación del latido rítmico regular del corazón es uno de los trastornos más frecuentes observados en las cardiopatías. Los ritmos irregulares (arritmia) pueden ser una molestia menor o pueden indicar un problema grave. Por ejemplo, las arritmias pueden indicar una anomalía subyacente en el músculo, válvulas o arterias cardíacos e incluyen la situación en la que el corazón está latiendo demasiado lentamente (bradicardia) y también en la que el corazón está latiendo demasiado rápidamente (taquicardia).
Las taquicardias se clasifican en dos tipos generales: taquicardias supraventriculares y taquicardias ventriculares.
Las taquicardias supraventriculares incluyen la taquicardia paroxística supraventricular (PSVT), la fibrilación auricular, el aleteo auricular, la reentrada en el nódulo AV y el síndrome de Wolff-Parkinson White (WPW). La taquicardia supraventricular (SVT) es una enfermedad en la que los impulsos eléctricos que se desplazan a través del corazón son anormales a causa de un problema cardíaco en alguna parte por encima de las cámaras inferiores del corazón. La SVT puede implicar frecuencias cardíacas de 140 a 250 latidos por minuto (lo normal es aproximadamente de 70 a 80 latidos por minuto).
Las taquicardias ventriculares incluyen la propia taquicardia ventricular, así como la fibrilación ventricular y taquicardia ventricular en entorchado (TdP). La taquicardia ventricular (VT) es un ritmo cardíaco rápido que se origina en los ventrículos. La VT tiende a interrumpir la contracción ordenadamente del músculo ventricular, de modo que la capacidad del ventrículo para impulsar la sangre se reduce a menudo significativamente. Esto, combinado con la frecuencia cardíaca excesiva, puede reducir la cantidad de sangre que está siendo bombeada realmente por el corazón durante la VT a niveles peligrosos. En consecuencia, aunque los pacientes con VT pueden sentirse algunas veces relativamente bien, con frecuencia experimentan (además de las palpitaciones omnipresentes) mareos extremos, pérdida de la conciencia o incluso muerte súbita. Por regla general, la VT no se produce en pacientes sin cardiopatía subyacente. Para la gente que padece cardiopatía subyacente, generalmente es cierto que cuanto peor es la función ventricular izquierda, mayor es el riesgo de desarrollar taquicardias ventriculares que ponen en peligro la vida.
Las taquicardias ventriculares pueden surgir en situaciones de isquemia de miocardio tales como angina inestable, angina crónica, angina variable, infarto de miocardio, síndrome coronario agudo y además en la insuficiencia cardíaca, tanto aguda como crónica.
Existe una enfermedad conocida como prolongación anormal de repolarización, o síndrome de QT prolongado (LQTS), que se refleja en un mayor intervalo medio entre la onda Q y la onda T medidas por EKG. La prolongación del intervalo QT hace a los pacientes vulnerables a un ritmo cardíaco anormal, muy rápido (una "arritmia") conocida como taquicardia ventricular en entorchado. Cuando se produce la arritmia, no se bombea sangre fuera del corazón, y el cerebro se ve privado rápidamente de sangre, lo que produce la pérdida repentina de la consciencia (síncope) y conduce potencialmente a la muerte súbita.
El LQTS es producido por la disfunción de los canales iónicos del corazón o por fármacos. Estos canales controlan la circulación de los iones potasio, los iones sodio y los iones calcio, cuya circulación dentro y fuera de las células genera la actividad eléctrica del corazón. Los pacientes con LQTS normalmente no tienen ninguna cardiopatía estructural subyacente identificable. El LQTS puede ser heredado, con propensión a desarrollar una variedad determinada de taquicardia ventricular en determinadas circunstancias, por ejemplo, el ejercicio, la administración de determinados agentes farmacológicos o incluso durante el sueño. Alternativamente, los pacientes pueden adquirir el LQTS, por ejemplo por exposición a determinadas medicaciones de venta con receta.
La forma adquirida del LQTS puede ser producida por agentes farmacológicos. Por ejemplo, la incidencia de la taquicardia ventricular en entorchado (TdP) en pacientes tratados con quinidina se estima que oscila entre el 2,0 y el 8,8%. DL-sotalol ha sido asociado a una incidencia que oscila entre el 1,8 y el 4,8%. Una incidencia similar ha sido descrita para los agentes de antiarritmia de clase III más recientes, tales como dofetilida e ibutilida. De hecho, se ha demostrado también que un número cada vez más creciente de agentes no cardiovasculares agravan y/o precipitan TdP. Se ha publicado que más de 50 fármacos disponibles en el mercado producen TdP. Este problema parece surgir más frecuentemente con los fármacos más recientes y numerosos han sido retirados del mercado en los últimos años (p. ej. prenilamina, terodilina y en algunos países terfenadina, astemizol y cisaprida). Se ha demostrado que la TdP producida por fármacos se desarrolla en gran medida como consecuencia de un aumento en la dispersión de la repolarización secundaria para el aumento de las heterogeneidades eléctricas intrínsecas del miocardio ventricular.
La mayoría de los agentes farmacológicos que son capaces de producir repolarización prolongada y el LQTS adquirido pueden agruparse en la medida que actúan principalmente por uno de los cuatro mecanismos diferentes (1) un retardo de una o ambas corrientes IKs e IKj de K. Son ejemplos quinidina, N-acetilprocainamida, cesio, sotalol, bretylium, clofilium y otros nuevos agentes antiarrítmicos de clase III (esta acción podría ser posiblemente antagonizada específicamente por fármacos que activan el canal de K, tales como pinacidil y cromakalin); (2) supresión de Ito, como en el caso de la 4-aminopiridina, que se demostró que prolonga la repolarización y produce las EAD preferentemente en las células M subepicardiales caninas, que se publicó que tienen Ito prominente; (3) un aumento en ICa, como en el caso de Bay K 8644 (esta acción pudo ser invertida por los bloqueantes del canal de Ca); (4) un retardo de la inactivación de INa, como en el caso de aconitina, veratridina, batracotoxina, DPI y las toxinas de la anémona de mar (ATX), antopleurina-A (AP-A) y ATX-II (esta acción pudo ser antagonizada por fármacos que bloquean la INa y/o inactivan lentamente la corriente de Na, tales como la lidocaína y la mexiletina). Debido a estos fármacos (p. ej., la lidocaína y la mexiletina) pueden acortar la repolarización prolongada, también pueden suprimir las EAD producidas por los dos primeros mecanismos.
La lista de fármacos que producen LQTS y TdP está aumentando continuamente. Literalmente, cualquier agente farmacológico que pueda prolongar QT puede producir el LQTS. La incidencia de TdP no se ha correlacionado con las concentraciones en el plasma de fármacos que se conoce que precipitan esta arritmia. Sin embargo, concentraciones elevadas en el plasma, resultantes de la dosis excesiva o del metabolismo reducido de algunos de estos fármacos, pueden aumentar el riesgo de precipitar la TdP. Dicho metabolismo reducido puede resultar de la utilización simultánea de otros fármacos que interfieren...
Reivindicaciones:
1. Compuesto seleccionado de entre el grupo constituido por un compuesto de fórmula I:

en la que:
R1, R2, R3, R4 y R5 son cada uno independientemente hidrógeno, alquilo inferior, alcoxi inferior, ciano, trifluorometilo, halo, alquiltio inferior, alquilsulfinilo inferior, alquilsulfonilo inferior o alquilamido opcionalmente N-sustituido, con la condición de que cuando R1 sea metilo, R4 no sea metilo; o R2 y R3 formen conjuntamente -OCH2O-;
R6, R7, R8, R9 y R10 son cada uno independientemente hidrógeno, acilo inferior, aminocarbonilmetilo, ciano, alquilo inferior, alcoxi inferior, trifluorometilo, halo, alquiltio inferior, alquilsulfinilo inferior, alquilsulfonilo inferior o dialquilamino inferior; o
R6 y R7 forman conjuntamente -CH=CH-CH=CH-; o
R7 y R8 forman conjuntamente -O-CH2O-;
R11 y R12 son cada uno independientemente hidrógeno o alquilo inferior; y
W es oxígeno o azufre;
en la que alquilo inferior se refiere a una cadena de hidrocarburo no ramificada saturada de 1 a 4 carbonos y acilo inferior se refiere al grupo RC(O)A, en el que R es alquilo inferior y A
representa el punto de acoplamiento;
un isómero de un compuesto de fórmula I, y una sal farmacéuticamente aceptable o un éster de un compuesto de fórmula I o su isómero
para su utilización en la supresión de las posdespolarizaciones precoces (EAD) en un mamífero.
2. Compuesto para la utilización según la reivindicación 1 que es la ranolazina, que se denomina N-(2,6-dimetilfenil)-4-[2-hidroxi-3-(2-metoxifenoxi)propil]-1-piperazinacetamida, o un isómero de la misma o una sal farmacéuticamente aceptable de la ranolazina o su isómero.
3. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración a niveles de dosis que inhiben los canales iónicos IKr, IKs e INa tardío pero no inhiben los canales de calcio.
4. Compuesto para la utilización según la reivindicación 2, que es la ranolazina en forma de una sal farmacéuticamente aceptable.
5. Compuesto para la utilización según la reivindicación 4, en el que la sal farmacéuticamente aceptable es la sal dihidrocloruro.
6. Compuesto para la utilización según la reivindicación 2, que es la ranolazina en forma de base libre.
7. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración que comprende un nivel de dosis que inhibe los canales iónicos de INa tardío.
8. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración que comprende un nivel de dosis que inhibe los canales iónicos de IKr, IKs e INa tardío.
9. Compuesto para la utilizacion según la reivindicación 1, que está destinado a la administración que comprende un nivel de dosis que inhibe los canales iónicos de IKr, IKs e INa tardío pero no inhibe los canales de calcio.
10. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración de manera que proporciona niveles en el plasma del compuesto de Fórmula I de por lo menos 350
11. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración en una formulación de liberación sostenida que mantiene concentraciones en el plasma del compuesto inferiores a un máximo de 4.000 ng/ml, preferentemente entre aproximadamente 350 a aproximadamente 4.000 ng/ml, durante por lo menos 12 horas.
12. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración en una formulación que contiene entre aproximadamente 10 mg y 700 mg de dicho compuesto.
13. Compuesto para la utilización según la reivindicación 12, que es la ranolazina o un isómero de la misma, o una sal farmacéuticamente aceptable de la ranolazina o su isómero.
14. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración en una formulación que proporciona un nivel de dosis comprendido entre aproximadamente 1 y aproximadamente 30 micromoles por litro de la formulación.
15. Compuesto para la utilización según la reivindicación 14, en el que dicha formulación proporciona un nivel de dosis comprendido entre aproximadamente 1 y aproximadamente 10 micromoles por litro de la formulación.
16. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración por inyección intravenosa rápida o composición de liberación sostenida.
17. Compuesto para la utilización según la reivindicación 1, que está destinado a la administración intravenosa.
18. Utilización de un compuesto de fórmula I:

en la que:
R1, R2, R3, R4 y R5 son cada uno independientemente hidrógeno, alquilo inferior, alcoxi inferior, ciano, trifluorometilo, halo, alquiltio inferior, alquilsulfinilo inferior, alquilsulfonilo inferior, o alquilamido opcionalmente N-sustituido, con la condición de que cuando R1 sea metilo, R4 no sea metilo; o R2 y R3 formen conjuntamente -OCH2O-;
R6, R7, R8, R9 y R10 son cada uno independientemente hidrógeno, acilo inferior, aminocarbonilmetilo, ciano, alquilo inferior, alcoxi inferior, trifluorometilo, halo, alquiltio inferior, alquilsulfinilo inferior, alquilsulfonilo inferior o, dialquilamino inferior; o
R6 y R7 forman conjuntamente -CH=CH-CH=CH-; o
R7 y R8 forman conjuntamente -O-CH2O-;
R11 y R12 son cada uno independientemente hidrógeno o alquilo inferior; y
W es oxígeno o azufre;
en la que alquilo inferior se refiere a una cadena de hidrocarburo no ramificada saturada de 1 a 4 carbonos y acilo inferior se refiere al grupo RC(O)A, siendo R alquilo inferior y A
representa el punto de acoplamiento;
o un isómero de los mismos, o una sal farmacéuticamente aceptable o un éster de un compuesto de fórmula I o su isómero
para la preparación de una composición farmacéutica destinada a suprimir las EAD en un mamífero.
19. Utilización según la reivindicación 18, en la que el compuesto de Fórmula I es la ranolazina, que se denomina N-(2,6-dimetilfenil)-4-[2-hidroxi-3-(2-metoxifenoxi)propil]-1-piperazinacetamida, o un isómero de la misma o una sal farmacéuticamente aceptable de la ranolazina o su isómero.
20. Utilización según la reivindicación 18, en la que la composición farmacéutica está destinada a la administración del compuesto de Fórmula I a niveles de dosis que inhiben los canales iónicos IKr, IKs e INa tardío pero no inhiben los canales de calcio.
21. Utilización según la reivindicación 19, en la que la ranolazina está en forma de sal farmacéuticamente aceptable.
22. Utilización según la reivindicación 21, en la que la sal farmacéuticamente aceptable es la sal dihidrocloruro.
23. Utilización según la reivindicación 19, en la que la ranolazina está en forma de base libre.
24. Utilización según la reivindicación 18, en la que la composición farmacéutica está destinada a la administración del compuesto de Fórmula I que comprende un nivel de dosis que inhibe los canales iónicos de INa tardío.
25. Utilización según la reivindicación 18, en la que la composición farmacéutica está destinada a la administración del compuesto de Fórmula I que comprende un nivel de dosis que inhibe los canales iónicos de IKr, IKs e INa tardío.
26. Utilización según la reivindicación 18, en la que la composición farmacéutica está destinada a la administración del compuesto de Fórmula I que comprende un nivel de dosis que inhibe los canales iónicos de IKr, IKs e INa tardío pero no inhibe los canales de calcio.
27. Utilización según la reivindicación 18, en la que la composición farmacéutica está destinada a la administración del compuesto de Fórmula I de manera que proporciona niveles en el plasma del compuesto de Fórmula I de por lo menos 350
28. Utilización según la reivindicación 18, en la que la composición farmacéutica es una formulación de liberación sostenida que mantiene concentraciones en el plasma del compuesto inferiores a un máximo de 4.000 ng/ml, preferentemente entre aproximadamente 350 a aproximadamente 4.000 ng/ml durante por lo menos 12 horas.
29. Utilización según la reivindicación 18, en la que la composición farmacéutica contiene entre aproximadamente 10 mg y 700 mg de dicho compuesto.
30. Utilización según la reivindicación 29, en la que el compuesto de Fórmula I es la ranolazina, o un isómero de la misma, o una sal farmacéuticamente aceptable de la ranolazina o su isómero.
31. Utilización según la reivindicación 18, en la que la composición farmacéutica proporciona un nivel de dosis comprendido entre aproximadamente 1 y aproximadamente 30 micromoles por litro de composición farmacéutica.
32. Utilización según la reivindicación 31, en la que la composición farmacéutica proporciona un nivel de dosis comprendido entre aproximadamente 1 y aproximadamente 10 micromoles por litro de composición farmacéutica.
33. Utilización según la reivindicación 18, en la que la composición farmacéutica debe administrarse por inyección intravenosa rápida o composición de liberación sostenida.
34. Utilización según la reivindicación 18, en la que la composición farmacéutica debe administrarse por vía intravenosa.
Patentes similares o relacionadas:
Análogos de (E)-N''-(1-feniletiliden) benzohidrazida sustituida como inhibidores de desmetilasas de histonas, del 15 de Julio de 2020, de UNIVERSITY OF UTAH RESEARCH FOUNDATION: Un compuesto que tiene una estructura representada por una fórmula: **(Ver fórmula)** en donde m es 1; n es un número entero de 0 a […]
Antagonista del receptor NK1, del 27 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Un compuesto representado por la fórmula (I): **(Ver fórmula)** donde W es un átomo de hidrógeno o un átomo de flúor; el anillo A es un […]
Formulación granular compleja con estabilidad mejorada, que comprende levocetirizina y montelukast, del 13 de Mayo de 2020, de HANMI PHARM. CO., LTD.: Una formulación granular compleja que comprende: (a) una primera parte granular que comprende levocetirizina o una sal farmacéuticamente aceptable de la misma, ciclodextrina […]
Composiciones y compuestos terapéuticos, del 6 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un compuesto de Fórmula (I) o una sal del mismo farmacéuticamente aceptable, en donde: **(Ver fórmula)** A es arilo o heteroarilo, en donde el arilo o heteroarilo […]
Composiciones farmacéuticas para terapia de combinación, del 29 de Abril de 2020, de Acesion Pharma ApS: Una combinación de (i) un inhibidor del canal de potasio (SK) activado por calcio de pequeña conductancia, o una sal o solvato farmacéuticamente aceptable de este; […]
Combinaciones de inhibidores de histona desacetilasa y fármacos inmunomoduladores, del 29 de Abril de 2020, de Acetylon Pharmaceuticals, Inc: Una combinación farmacéutica para su uso en el tratamiento del linfoma que comprende una cantidad terapéuticamente eficaz de un inhibidor específico de histona desacetilasa […]
Formulaciones farmacéuticas de liberación controlada de nitazoxanida, del 15 de Abril de 2020, de ROMARK LABORATORIES, L.C.: Composición farmacéutica en forma de una forma de dosificación oral sólida que comprende: (a) una primera parte que comprende una primera […]
Composiciones congeladas fluidas que comprenden un agente terapéutico, del 8 de Abril de 2020, de Tavakoli, Zahra: Una composición fluida congelada que comprende un agente terapéutico y al menos un agente aromatizante para su uso en terapia, donde dicha composición […]